 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
画出下列配离子的电子排布式,指出杂化轨道的名称及配离子的空间构型。(A)外轨型:[CuCl2]卐
画出下列配离子的电子排布式,指出杂化轨道的名称及配离子的空间构型。
(A)外轨型:[CuCl2]-,[AIF6]3-,[NiCl2(NH3)2];
(B)内轨型:[Pt(NH3)4]2+,[Pt(CN)4]2-。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
画出下列配离子的电子排布式,指出杂化轨道的名称及配离子的空间构型。
(A)外轨型:[CuCl2]-,[AIF6]3-,[NiCl2(NH3)2];
(B)内轨型:[Pt(NH3)4]2+,[Pt(CN)4]2-。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“画出下列配离子的电子排布式,指出杂化轨道的名称及配离子的空间…”相关的问题
更多“画出下列配离子的电子排布式,指出杂化轨道的名称及配离子的空间…”相关的问题
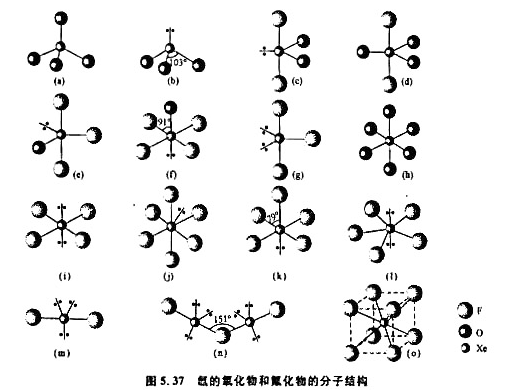
图5.37示出氙的氟化物和氧化物的分子(或离子)结构。
(1)根据图形及VSEPR理论,指出分子的几何构型名称和所属点群;
(2)Xe原子所用的杂化轨道;
(3)Xe原子的表观氧化态;
(4)已知在XeF2,XeF4,加合物晶体中,两种分子的构型与单独存在时的几何构型相同,不会相互化合成XeF2,从中说明什么问题?
画出下列分子中孤对电子和键对电子在空间的排布图:
(1)ICl2-,N2O;
(2)H3O+,BrF3,NF3;
(3)ICl4-,IF4+,SbF4-,XeO3F2;
(4)IF3,XeF5+。
A、原子中一个电子的运动状态需要用四个量子数描述
B、电子在简并轨道上排布时尽可能分占不同的轨道,且自旋方向相同
C、在同一原子中,不可能有两个电子具有相同的四个量子数
D、在s能级中均有两个自旋方向相反的电子存在
直线形对称构型的I3-离子若成键电子只是5p轨道上的电子(即将5s2电子作为原子实的一部分)。
(1)画出I3-中每个和π轨道的原子轨道叠加图;
(2)面出I2-分子轨道能级图;
(3)试以I原子间的键长(d)和键级(n)关系方程;d=267pm-(85pm)logn,计算I3-中I-I键的键级。实验测定I2分子中I—I键长为267pm,而I3-中I-I键长为292pm。
A、杂化轨道是由不同原子的价层能量相近的原子轨道组合而成
B、有几个原子轨道参加杂化,就形成几个杂化轨道
C、杂化轨道比杂化前的原子轨道成键能力强
D、不同类型的杂化轨道间的夹角不同