 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原理如下图所示。下列说法不正确的是()。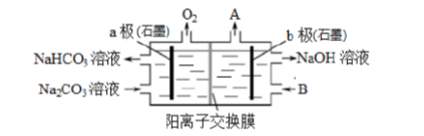
A.b极为阴极,产生的气体A为H2
B.溶液中的Na+通过交换膜由b极室到a极室
C.B可以使用稀NaOH溶液,其效果优于纯水
D.a极电极反应为4CO32-+2H2O-4e-=4HCO3-+O2↑
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)

A.b极为阴极,产生的气体A为H2
B.溶液中的Na+通过交换膜由b极室到a极室
C.B可以使用稀NaOH溶液,其效果优于纯水
D.a极电极反应为4CO32-+2H2O-4e-=4HCO3-+O2↑
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原…”相关的问题
更多“电解Na2CO3溶液可制取NaHCO3溶液和NaOH溶液,原…”相关的问题
A.NaOH+Na2CO3
B.Na2CO3+NaHCO3
C.NaHCO3
D.Na2CO3
(1)试液中所含的NaOH和Na2CO3的物质的量相同;
(2)试液中所含的NaHCO3和Na2CO3的物质的量相同;
(3)加入甲基橙时.试液呈终点颜色。前两种情况下,若继续以甲基橙为指示剂,还需要加入多少毫升HCl溶液才能滴定至终点?第三种情况的试液组成如何?
A.①过滤②加过量的NaOH溶液③加适量盐酸④加过量Na2CO3溶液⑤加过量BaCl2溶液
B.①④②⑤③
C.④①②⑤③
D.②⑤④①③
E.⑤②④①③
下列叙述正确的是()。①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物②Na2CO3溶液和NaHCO3溶液都能跟CaCl2溶液反应得到白色沉淀③钠在常温下不容易被氧化④Na2O2可作供氧剂,而Na2O不行⑤石蕊试液中加入Na2O2粉末,先变蓝后褪色,并有气泡生成⑥钠与浓NH4Cl溶液反应,放出的气体中含H2和NH3。
A.都正确
B.②③④⑤
C.④⑤⑥
D.②⑤⑥
问题1、自然界一切物质都具有能量,而且能量可以相互转化。从能量来看,电解是()转变为()的过程。能量的转化很多是以热量的形式出现的,例如甲烷作为一种清洁能源,标准状况下燃烧0.448L甲烷生成液态水,放出QKJ热量,写出该反应的热化学方程式()。问题2、写出电解饱和食盐水的离子方程式()。问题3、试预测离子交换膜法电解食盐水中离子交换膜可能的作用是()、()。问题4、电解熔融的氧化钠可以得到金属钠。写出该反应的化学方程式()。铝也可以用电解法得到,请用一个实验事实说明钠与铝的金属性强弱()。 问题5、室温下,0.1mol/LNaCIO溶液的pH()0.1mol/LNa2SO3溶液的pH。(选填“大于”、“小于”或“等于”)。浓度均为0.1mol/L的Na2SO3和Na2CO3的混合溶液中,SO32-、CO32-、HSO3-、HCO3-浓度从大到小的顺序为()。(酸性:H2SO3>H2CO3>HSO3->HCIO>HCO3-)。
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: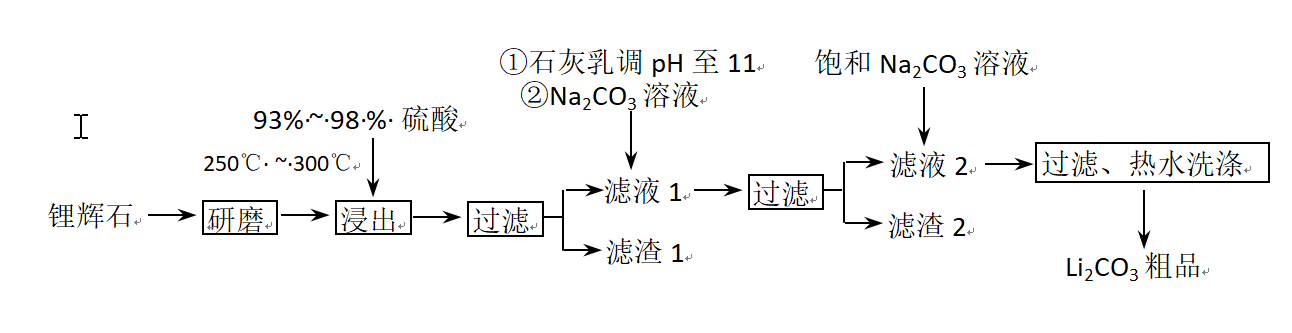 已知:①
已知:①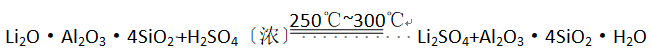 ②某些物质的溶解度(S)如下表所示
②某些物质的溶解度(S)如下表所示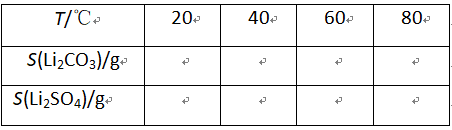
问题一、从滤渣1中别离出Al2O3的部分流程如以下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是()。
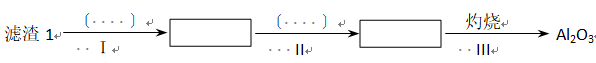
问题二、已知滤渣2的主要成分有Mg(OH)2和CaCO3向滤液1中加入石灰乳的作用是(运用化学平衡原理简述)()
问题三、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是()
问题四、工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下()
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3
①a中,阳极的电极反应式是()。
②b中,生成Li2CO3反应的化学方程式是()。
已知试样中含有Na2CO3,NaHCO3和惰性杂质,称取样品0.527g,用0.109mol/L-1HCl滴定,需15.7mL,到达酚酞终点。当到达甲基橙终点时,所用滴定剂总体积为43.8mL,问混合物中Na2CO3,NaHCO3的质量分数。M(Na2CO3)=105.99g·mol-1,M(NaHCO3)=84.01g·mol-1