 更多“分别计算下列各混合溶液中的pH;”相关的问题
更多“分别计算下列各混合溶液中的pH;”相关的问题
第1题
试计算:(1)pH=1.00与pH=2.00的HCl溶液等体积混合后溶液的pH.(2)pH=200的HCI溶液与pH=13.00的NaOH溶液等体积混合后溶液的pH.
试计算:(1)pH=1.00与pH=2.00的HCl溶液等体积混合后溶液的pH.(2)pH=200的HCI溶液与pH=13.00的NaOH溶液等体积混合后溶液的pH.
点击查看答案
第2题
在国际多式联运运输中,混合制计费方式是指按照组成多式联运的各运输区段,分别计算海运、陆运(铁路
、汽车)、空运及港站等各项费用,然后合计为多式联运的全程运费,由多式联运经营人向货主一次计收的方式。()
点击查看答案
A.正确
B.错误
第3题
设计一个分别测定混合溶液中As02-和As043-的分析方案(原理、简单步骤和计算公式)。
设计一个分别测定混合溶液中As02-和As043-的分析方案(原理、简单步骤和计算公式)。
点击查看答案
第4题
称取不纯的未知一元弱酸HA(摩尔质量为82.00g.mo1-1)试样1.600g,溶解后稀释至60.00ml,以0. 2500mol·L-1 NaOH进行电位滴定。已知HA被中和一半时溶液的pH=5.00。而中和至计量点时溶液的pH=9.00.计算试样中HA的质量分数。
称取不纯的未知一元弱酸HA(摩尔质量为82.00g.mo1-1)试样1.600g,溶解后稀释至60.00ml,以0. 2500mol·L-1NaOH进行电位滴定。已知HA被中和一半时溶液的pH=5.00。而中和至计量点时溶液的pH=9.00.计算试样中HA的质量分数。
点击查看答案
第5题
已知电极反应:计算下列反应:(1)在298K时的平衡常数;(2)如果pH=7,其他物质浓度均为标准态,反应
已知电极反应:
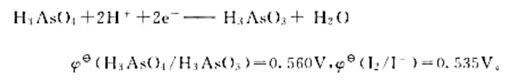
计算下列反应:
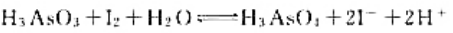
(1)在298K时的平衡常数;
(2)如果pH=7,其他物质浓度均为标准态,反应向什么方向进行?
(3)如果溶液的c(H+)=6.0mol·L-1.其他物质浓度均为标准态.反应向什么方向进行?
第7题
称取石灰石试样0.2503g,溶于盐酸制备成溶液后,移入100mL容量瓶中加水稀释至刻度。吸取25.00mL该
试样,在pH=12时,以KB为指示剂,用浓度为0.02500molL1的EDTA标准溶液滴定,消耗24.00mL。计算试样中以CaO表示的含量。
点击查看答案
(已知CaO的摩尔质量58.06gmol1)
第10题
称取含Fe2O3和Al2O3的试样0.2000g。将其溶解,在pH=2.0的热溶液中(50℃左右)
称取含Fe2O3和Al2O3的试样0.2000g。将其溶解,在pH=2.0的热溶液中(50℃左右)
点击查看答案
,以磺基水杨酸为指示剂。用0.02000mol·L-1EDTA标准溶液滴定试样中的Fe3+。用去18.16ml.然后将试液调至pH=3.5,加入上述EDTA标准溶液25.0mL,并加热煮沸。再调试液pH=4.5.以PAN为指示剂,趁热用CuSO4标准溶液(每毫升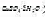 为0.005000g)返滴定,用去8.12mL.计算试样中Fe2O3,和Al2O3,的质量分数。
为0.005000g)返滴定,用去8.12mL.计算试样中Fe2O3,和Al2O3,的质量分数。
第11题
计算用0.1000mol·L-1HCl溶液滴定20.00mL 0.10mol·L-1NH4溶液时,(1)计量点(2)计量点前后±0.1%相对误差时溶液的pH(3)选择哪种指示剂?


 如果结果不匹配,请
如果结果不匹配,请 
 试计算0.10mol-1·L-1HCOONH4溶液的pH。
试计算0.10mol-1·L-1HCOONH4溶液的pH。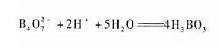
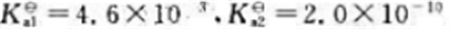 试计算0.10mol·L-1丙氨酸溶液的pH。
试计算0.10mol·L-1丙氨酸溶液的pH。
















