 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
下列电池,其电动势为0.568V,计算HA的离解常数。
下列电池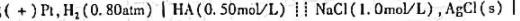
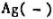 ,其电动势为0.568V,计算HA的离解常数。
,其电动势为0.568V,计算HA的离解常数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 题目内容
(请给出正确答案)
题目内容
(请给出正确答案)
下列电池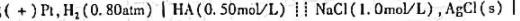
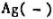 ,其电动势为0.568V,计算HA的离解常数。
,其电动势为0.568V,计算HA的离解常数。
 如果结果不匹配,请 联系老师 获取答案
如果结果不匹配,请 联系老师 获取答案
 更多“下列电池,其电动势为0.568V,计算HA的离解常数。”相关的问题
更多“下列电池,其电动势为0.568V,计算HA的离解常数。”相关的问题
用下列电池按直接电位法测定草酸根离子浓度。
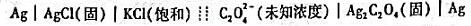
(1)推导出pC2O4与电池电动势之间的关系式
(2)若将一未知浓度的草酸钠溶液置入此电池,在25℃时测得电池电动势为0.402V,Ag-AgCl电极为负极,计算未知溶液的pC2O4。(已知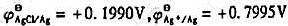 )
)
根据下列反应组成电池
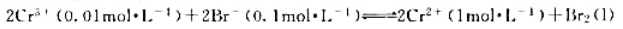
(1)写出电池符号;
(2)计算298K时的电动势,并判断反应自发进行的方向;
已知
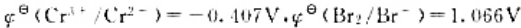
电池:(一)玻璃电极丨H+(a=?)饱和汞电极(),在25℃时,对pH等于4.00的缓冲溶液,测得电池的电动势为0.209V,当缓冲液由未知液代替时,测得电池的电动势为0.088V,计算未知液的pH.
为测定下列吡啶与水之间的质子转移反应的平衡常数,
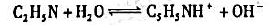
安装以下电池:
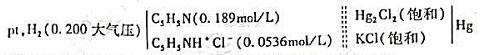
若25℃时电池电动势为0.563V,上述反应的平衡常数Kb为多少?
用氟离子选择性电极与Ag/AgC1电极组成测量电池

取25.00mL水样加入25.00mL总离子强度调节液得溶液A,测得其电池电动势为-325mV,若在A溶液中加入1mL1.00X10-3mo1/L溶液,测得电池电动势为-31TmV,若将A溶液用总离子强度调节液稀释一倍,测得电动势为-342mV,求水样中含氟的浓度为多少?
A.电对Fe3+/Fe2+做正极
B.反应Fe+2Fe3+=3Fe2+的平衡常数大约为8×1040
C.电池组成式为(-)Fe|Fe2+(c1)||Fe2+(c2),Fe3+(c3)|Pt()
D.电池的标准电动势为0.331V
有如下两个电池:
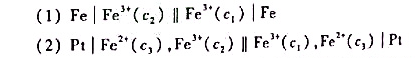
测得其电动势分别为E(1)和E(2),试求E(1)与E(2)之比。
已知反应
2Cr3++3Cl2+7H2O=Cr2O72-+6C1-+14H+
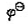 (Cr2O72-/Cr3+)=1.33V,
(Cr2O72-/Cr3+)=1.33V,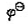 (Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(Cl2/CI-)=1.36V,F=95500J·V-1·mol-2若在298K时组成原电池。
(1)写出该原电监的电池符号,并计算标准电动势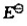 ;(2)计算
;(2)计算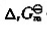 (298K)并判断反应进行的方向;(3)计算标准平衡常数
(298K)并判断反应进行的方向;(3)计算标准平衡常数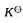 ;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向
;(4)若c(H+)=10mol·dm-3,其他离子浓度均为标准浓度,求原电池的电动势E并判断反应进行的方向